Forschung
Forschungsgebiet
Die Forschungsschwerpunkte der Arbeitsgruppe liegen auf der Analyse und Modulation krankheitsbezogener Wirkungen des angeborenen Immunsystems. Das angeborene Immunsystem wird unmittelbar nach Kontakt mit Krankheitserregern aktiviert, aber auch durch korpereigene Komponenten, die nach einer Gewebeschädigung freigesetzt werden. Das angeborene Immunsystem lost Entzundungsreaktionen aus, die fur eine fruhe Kontrolle von Erregern verantwortlich sind, und leitet die Aktivierung des adaptiven Immunsystems ein, wodurch spezifische Abwehrleistungen und ein immunologische Gedachtnis vermittelt werden. Eine fehlerhafte Regulation der angeborenen Immunantwort kann allerdings auch entscheidend zu Krankeiten wie Sepsis und Krebs beitragen und regenerative Prozesse
Sepsis
Sepsis bezeichnet eine lebensbedrohliche Organdysfunktion, die durch eine fehlgesteuerte Immunantwort auf Infektionserreger verursacht wird. In Deutschland sterben mehr Menschen an Sepsis als an den häufigsten drei Krebsarten oder Herzinfarkten, die Mortalität liegt bei mehr als 30%. Die Pathophysiologie der Sepsis ist geprägt durch eine fehlerhafte Balance der Immunantwort. Während zu Beginn der Sepsis eine überschießende Immunantwort und ein damit einhergehender Zytokinsturm das Krankheitsbild bestimmen, kommt es bei fortschreitender Sepsisdauer zu einer starken Immunsuppression. Eigene Arbeiten konnten Toll-like Rezeptoren als eine wesentliche Ursache des initialen Zytokinsturms identifizieren. Ebenso konnten wir zeigen, dass die Immunsuppression bereits zu Sepsisbeginn auftritt, aber erst im weiteren Krankheitsverlauf dominiert. In der Arbeitsgruppe von Prof. Dr. Matthias Feige (Labor für Zelluläre Proteinbiochemie, Technische Universität München) wurde die Zytokinuntereinheit IL-27α strukturell modifiziert, sodass das Molekül von Zellen freigesetzt werden kann und immunmodulierende Wirkungen entfaltet. Zusammen mit Prof. Dr. Feige arbeiten wir daran, modifiziertes IL-27α als neues Biopharmazeutikum in der Sepsistherapie zu validieren. Ziel dieses Therapieansatzes ist es, die verlorene Immunbalance in der Sepsis wieder herzustellen.
Leberregeneration
Die Leber besitzt eine hohe Fähigkeit zur Regeneration. Auch die Resektion größerer Anteile der Leber kann über eine zeitlich und örtlich koordinierte Proliferation des Restgewebes kompensiert werden (Abb. 1). Auf dieser Eigenschaft beruhen die aktuell etablierten Resektionsverfahren an der Leber, die von der Leberteiltransplantation bis hin zur chirurgischen Therapie bösartiger Neubildungen reichen. Das Ausmaß der Resektion und damit die therapeutischen Optionen werden allerdings durch die postoperative Funktion der Restleber und deren Regenerationsfähigkeit limitiert. Ziel der Forschungsarbeiten ist es, die der Leberregeneration zugrunde liegenden Mechanismen weiter aufzuklären. Hierfür entwickeln wir unter anderem komplexe in vitro-Kultursysteme aus primären Zellen des Leberparenchyms wie Hepatozyten, Kupffer Zellen (Makrophagen) und Sternzellen.
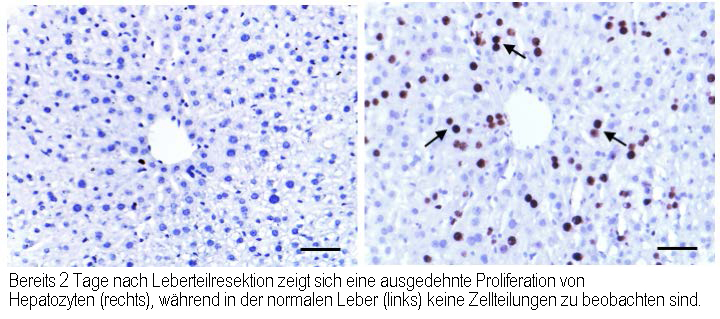
Eine erfolgreiche Leberregeneration beruht auf dem Zusammenwirken verschiedener Zellarten, wobei das angeborene Immunsystem eine wichtige Rolle spielt. Eigene Arbeiten zeigen, dass während der Leberregeneration immunstimulierende Nukleinsäuren in extrazellulären Vesikeln freigesetzt werden und das angeborenen Immunsystem über verschiedene Signalwege aktivieren. (1) Zytosolische Nukleinsäure-Rezeptoren wirken dabei über die Signalmoleküle MAVS und STING und dämmen die Produktion und Wirkung wachstumshemmender Faktoren wie TGF-β und Activin A ein. (2) Komplementär zu diesem Mechanismus fördert der endosomale Nukleinsäure-Rezeptor TLR3 die proteolytische Freisetzung des Wachstumsfaktors HGF aus der extrazellulären Matrix der Leber durch Erhöhung der Urokinaseproduktion. In beiden Fällen werden die Hepatozyten in der Restleber zur Proliferation angeregt und die Regeneration der Leber wird gefördert.
Sensorische Nerven in der Leber setzen unmittelbar nach Hepatektomie das Neuropeptid CGRP frei. Eigene Arbeiten zeigen, dass CGRP nach Bindung an den Rezeptorkomplex bestehend aus RAMP1 und CLR angeborene Immunantworten supprimiert. Während der Leberregeneration ist dagegen die direkte Wirkung von CGRP auf Hepatozyten wichtig. Mechanistisch gesehen führt CGRP zu einer erhöhten Proteinexpression und Aktivierung der transkriptionellen Kofaktoren YAP und TAZ und trägt damit entscheidend zur Proliferation von Hepatozyten und somit zum Gewebeaufbau bei.
Entzündung und Krebs
Chronische Entzündungen, verursacht durch persistierende Infektionen oder andauernde Gewebeschäden, sind an der Entstehung zahlreicher Krebsarten beteiligt. Im Rahmen des SFB1321 untersuchen wir die Rolle des Immunrezeptors TLR3 bei der Entstehung des Pankreaskarzinoms. Mutationen im TLR3 Gen oder Genen von Komponenten des TLR3 Signalwegs finden sich in etwa 40% der Pankreaskarzinome und sind mit einem Überlebensnachteil verbunden. Die Azino-Duktale Metaplasie (ADM) fördert die Pankreasregeneration nach Gewebeschädigung und entsteht auf der Basis von Entzündungsreaktionen. Allerdings gelten Zellen in ADM Läsionen auch als Vorläufer für intraepitheliale Neubildungen, aus denen sich Pankreaskarzinome entwickeln können. Wie unsere Arbeiten zeigen wird TLR3 benötigt, um die Neubildung und Persistenz von ADM zu begrenzen. Ursächlich hierfür scheint zu sein, dass TLR3 den Zelltod von Makrophagen induziert und dadurch Entzündungsreaktionen begrenzt und schließlich vollständig auflöst. Laufende Arbeiten untersuchen die Bedeutung dieses Mechanismus bei der Entwicklung von Pankreaskarzinomen.
Link zu PubMed(link is external)
Hammer M, Echtenacher B, Weighardt H, Jozefowski K, Rose-John S, Männel D, Holzmann B, and Lang R. Increased inflammation and lethality of Dusp1-/- mice in polymicrobial peritonitis models. Immunology 2010; 131: 395-404.
Reim D, Roßmann-Bloeck T, Jusek G, Prazeres da Costa O, and Holzmann B. Improved host defense against septic peritonitis in mice lacking MyD88 and TRIF is linked to a normal interferon response. J. Leukoc. Biol. 2011; 90: 613-20.
Martini M, Gnann A, Scheikl D, Holzmann B, and Janssen KP. The candidate tumor suppressor SASH1 interacts with the actin cytoskeleton and stimulates cell-matrix adhesion. Int. J. Biochem. Cell. Biol. 2011; 43: 1630-40.
Novotny AR, Reim D, Assfalg V, Altmayr F, Friess HM, Emmanuel K *, and Holzmann B *. Mixed antagonist response and sepsis severity-dependent dysbalance of pro- and anti-inflammatory responses at the onset of postoperative sepsis. Immunobiology 2012; 217: 616-21. * equal contribution.
Gais P, Reim D, Jusek G, Rossmann-Bloeck T, Weighardt H, Pfeffer K, Altmayr F, Janssen KP, and Holzmann B. Cutting edge: Divergent cell-specific functions of MyD88 for inflammatory responses and organ injury in septic peritonitis. J. Immunol. 2012; 188: 5833-7.
Jusek G, Reim D, Tsujikawa K, and Holzmann B. Deficiency of the CGRP receptor component RAMP1 attenuates immunosuppression during the early phase of septic peritonitis. Immunobiology 2012; 217: 761-7.
Baliu-Piqué M, Jusek G, and Holzmann B. Neuroimmunological communication via CGRP promotes the development of a regulatory phenotype in TLR4-stimulated macrophages. Eur. J. Immunol. 2014; 44: 3708-16.
Holtorf A, Conrad A, Holzmann B, and Janssen KP. Cell-type specific MyD88 signaling is required for intestinal tumor initiation and progression to malignancy. Oncoimmunology 2018; 7: e1466770
Schulze S, Stöß C, Lu M, Wang B, Laschinger M, Steiger K, Altmayr F, Friess H, Hartmann D, Holzmann B*, and Hüser N*. Cytosolic nucleic acid sensors of the innate immune system promote liver regeneration after partial hepatectomy. Sci. Rep. 2018; 8:12271. *equal contribution
Polykratis A, Martens A, Eren RO, Shirasaki Y, Yamagishi M, Yamaguchi Y, Uemura S, Miura M, Holzmann B, Kollias G, Armaka M, van Loo G, Pasparakis M. A20 prevents inflammasome-dependent arthritis by inhibiting macrophage necroptosis through its ZnF7 ubiquitin binding domain. Nat. Cell Biol. 2019; 21: 731-42.
Jochheim L, Odysseos G, Hidalgo-Sastre A, Zhong S, Staufer LM, Kroiss M, Hartmann D, Hüser N, Steiger K, Schmid RM, Holzmann B, von Figura G. The neuropeptide receptor subunit RAMP1 constrains the innate immune response during acute pancreatitis in mice. Panreatology 2019; 19: 541-7.
Namineni S, O‘Connor T, Faure-Dupuy S, Johansen P, Riedl T, Liu K, Xu H, Singh I, Shinde P, Li F, Pandyra A, Sharma P, Ringelhan M, Muschaweckh A, Borst K, Blank P, Lampl S, Neuhaus K, Durantel D, Farhat R, Weber A, Lenggenhager D, Kündig TM, Staeheli P, Protzer U, Wohlleber D, Holzmann B, Binder M, Breuhahn K, Assmus LM, Nattermann J, Abdullah Z, Rolland M, Dejardin E, Lang PA, Lang KS, Karin M, Lucifora J, Kalinke U, Knolle PA, Heikenwalder M. A dual role for hepatocyte-intrinsic canonical NF-κB signaling in virus control. J. Hepatol. 2020; 72: 960-75.
Laschinger M, Wang Y, Holzmann G, Wang B, Stöß C, Lu M, Brugger M, Schneider A, Knolle P, Wohlleber D, Schulze S, Steiger K, Tsujikawa K, Altmayr F, Friess H, Hartmann D, Hüser N, and Holzmann B. The CGRP receptor component RAMP1 links sensory innervation with YAP activity in the regenerating liver. FASEB J. 2020; 34: 8125-38.
Stöß C, Laschinger M, Wang B, Lu M, Altmayr F, Hartmann D, Hüser N, and Holzmann B. TLR3 promotes hepatocyte proliferation after partial hepatectomy by stimulating uPA expression and the release of tissue-bound HGF. FASEB J. 2020; 34: 10387-97.
Gamrekelashvili J, Kapanadze T, Sablotny S, Ratiu C, Dastagir K, Lochner M, Karbach S, Wenzel P, Sitnow A, Fleig S, Sparwasser T, Kalinke U, Holzmann B, Haller H, and Limbourg F. Notch and TLR signaling coordinate monocyte differentiation during inflammation. eLife 2020 Jul 29; 9:e57007. doi: 10.7554/eLife.57007.
Hidalgo-Sastre A, Kuebelsbeck L, Jochheim L, Staufer LM, Altmayr F, Johannes W, Steiger K, Ronderos M, Hartmann D, Hueser N, Schmid RM, Holzmann B*, and von Figura G*. Toll-like receptor 3 expression in myeloid cells is essential for efficient regeneration after acute pancreatitis in mice. Eur. J. Immunol. 2021 Feb 1. doi: 10.1002/eji.202048771. *equal contribution




